Studien
Die Wirkung von Statinen ist in zahlreichen Studien untersucht worden. Exemplarisch für diese Studien wird hier die ‚Heart Protection Study‘ (HPS) betrachtet. Für die HPS-Studie wurden ca. 130.000 Patienten angeschrieben. Nur ca. 63.000 folgten der Einladung für eine Vorauswahl. Die Gründe, warum ehemalige Patienten nicht teilnahmen, können vielfältiger Art sein, dürften aber zu einem Großteil auf negativen Erfahrungen mit den Nebenwirkungen von Statinen beruhen. Die Patienten, die der Einladung nicht folgten, wurden nicht stichprobenartig untersucht. In der Vorauswahl wurden ca. 31.000 Patienten ausgeschlossen, die Gegenanzeigen für Statine aufgrund von Leber- und Muskelerkrankungen, Nierenfunktionsstörungen, anderer Medikamente hatten oder bei denen mangelnde Compliance [Therapietreue eines Patienten] vorlag.
„Es verblieben 32.145 Patienten, die in einer Vorlaufphase vier Wochen lang Placebo und danach sechs Wochen Simvastatin erhielten. Nach diesem Erstkontakt verabschiedeten sich weitere 11.609 Patienten, sodass schließlich 20.536 Patienten in die Studie eingeschlossen wurden. Dieses Vorgehen ist fragwürdig, denn durch den Simvastatin-Erstkontakt im Vorlauf wurden alle Patienten mit Nebenwirkungen aus der Studie im Vorfeld exkludiert, und die Autoren kamen daher irrigerweise zu der Aussage, dass die Nebenwirkungen im Placebo- und Simvastatin-Kollektiv bis auf die zweite Kommastelle nahezu identisch seien. Im Übrigen wurde die Studie dadurch entblindet und war somit anfällig für eine Ungleichbehandlung.“ (Conradi)
Bei den 11.609 (36%) Patienten, die im Vortest die Studie verließen, wird ein Großteil es aufgrund von Nebenwirkungen getan haben. Nach fünfjähriger Studiendauer nehmen 18% der Medikamentengruppe kein Statin mehr ein; auch hier dürften Nebenwirkungen ursächlich sein. Damit wächst der mutmaßliche Anteil der Patienten mit Statin-Unverträglichkeit auf 56%.
Die Ergebnisse der Studie sind statistisch zufällig
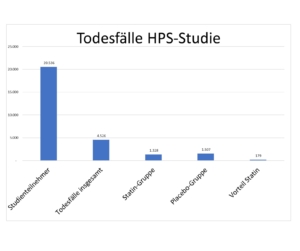
Im Laufe der Studie verstarben 27,6% (4.526) aller Teilnehmer, davon 12,9 % (1.328) der Medikament-Gruppe und 14,7% (1.507) der Placebo-Gruppe. Das bedeutet im Einzelnen:
1. Statine sind nicht in der Lage, den Tod durch KHK-Krankheiten wirksam zu reduzieren. Sie verschafften lediglich 179 Patienten bzw. 1,7 % der der Medikamentengruppe einen Überlebensvorteil. Die ‚Scandinavian Simvastatin Survival Study‘ (4S-Studie) zeigt mit 1,5% vergleichbare Ergebnisse. Das unabhängige Netzwerk Cochrane kommt in einer Meta-Studie auf 1,8% der Studienteilnehmer, bei denen ein größeres KHK-Ereignis verhindert werden könnte. (Cochrane) In Meta-Studie summieren sich die Fehler der zugrundeliegenden Studien auf.
2. Die Ergebnisse sind statistisch betrachtet zufällig. Um sich von zufälligen Ergebnissen zu unterscheiden muss – das ist Konsens für wissenschaftliche Untersuchungen – der Unterschied zwischen den beiden Gruppen mindestens 5% betragen, er beträgt aber lediglich 1,7%. Die Nullhypothese – es gibt keinen signifikanten Unterschied zwischen den beiden Gruppen – kann nicht zurückgewiesen werden, ein sogenannter ’statistischer Fehler 2. Art‘.
3. Die Todesfälle verteilen sich einigermaßen gleichmäßig auf den gesamten Untersuchungszeitraum. Die theoretische Lebensverlängerung in der Medikamentengruppe beträgt 1,4% (1.412 Jahre). Ob der ‚Vorteil‘ wirklich ein Effekt der Statine ist, ist aufgrund der Verletzung von Standards für Studien nicht gesichert.
4. Die Ausfallquote der Studie gemessen an allen einbezogenen Patienten beträgt 83%. Damit sind die Studienergebnisse nicht übertragbar.
„Das Ergebnis ist eindeutig. Die Unterschiede zwischen Placebo- und Simvastasin-Gruppe sind im statistischen Sinn nicht signifikant. Ein Unterschied wäre bei diesen kleinen Abweichungen nur dann als wirklich gegeben ansehbar, wenn mit sehr hoher Sicherheit ein statistischer Fehler auszuschließen ist. … Eine große Bedeutung kommt der Frage zu, ob die Placebo-Gruppe tatsächlich eine Placebo-Gruppe ist. Da es ein Ziel der Studie war, primär den Cholesterinwert zu senken, wurden alle Ärzte angewiesen, wenn sie es für nötig hielten, beliebige Lipidsenker zusätzlich einzusetzen. Am Ende der 5 Jahre nahmen 4002 Patienten – durch die Todesfälle ist das inzwischen etwa jeder Vierte – ’non-study‘-Statine, neben Simvastasin (53%) auch Atorvastasin (28%), Pravastasin (5%), Cerivastasin (5%) und Fluvastasin (4%). Das heißt, auch hier liegt ein statistisch bedeutender Irrtum von ca. 25 % vor. … Äußerst bedenklich ist, daß in der Placebo-Gruppe auch Cerivastasin, der Inhaltstoff des vom Markt genommenen Libobay, gegeben wurde, das laut Pasternak eine 16-80fach höhere Rhabdomyolyse-Rate hat als die anderen Statine. Möglicherweise befinden sich deshalb statistisch ein höherer Anteil aller Myopathien [Muskelerkrankungen], wenn nicht sogar alle, bei statinbehandelten Menschen.“ (Bayer)
Dennoch behaupten Befürworter von Statinen, es stehen „… in der modernen Therapie hochwirksame, meist sehr gut verträgliche Medikamente zur Verfügung …. Damit ließen sich Herz-Kreislauf-Erkrankungen verhindern.“ (Grützmacher)
Von 10.000 Menschen müssten 9.830 Menschen unnötig mit nebenwirkungsträchtigen, möglicherweise lebensgefährlichen Statinen behandelt werden, um bei 170 Patienten eine Lebensverlängerung von im Schnitt 2,5 Jahren zu erreichen.
Die sehr wichtige Frage – Wie geht es den Patienten mit dem Statin? – wird in keiner der Untersuchungen von Statinen gestellt. Eine Nebenwirkung von Statinen sind Depressionen. Depressive Verstimmungen wie schlechte Laune, Antriebsarmut usw. können auftreten, ohne als Krankheit diagnostiziert zu werden; oder leichte Muskelschmerzen, die als von Anderem verursacht abgetan werden können.
Der Trick relativer Risikoreduktion
Absolute Zahlen werden in Publikationen zu Statinen nur bei der Anzahl der Studienteilnehmer genannt. Prozentzahlen in den publizierten Statistiken und Werbung für Statine sind fast immer relative Prozentzahlen, die auch als ‚relative Risikoreduktionen‘ bezeichnet werden. In absoluten Prozentwerten sind die ‚Erfolge‘ der Studien so gering, dass die magere Wirkung augenfällig wäre. Beispiel dazu: „Durch eine Therapie ändert sich die Anzahl der Todesfälle von 6 auf 4 von 1000 Personen, das sind 2 von 1000. Die absolute Risikoreduktion ist 0,2 % – Die relative Risikoreduktion wäre hier 2 von 6 bzw. 33 %.“ (Wikipedia) Dieser Trick führt statistisch auch dazu, dass nicht signifikante Ergebnisse zu signifikanten manipuliert werden.
In Publikationen und Werbung zu Statinen wird regelmäßig nicht darauf hingewiesen, dass es sich um relative Risikoreduktionen handelt.
„Die geringe Inzidenz [Häufigkeit von Ereignissen] von Herzinfarkten und das damit verbundene statistische Problem, daß Aussagen über eine Risikominderung sich unterhalb des Signifikanzbereichs abspielen, wird überspielt, aber nicht gelöst, durch die Einführung einer ‚relativen‘ Risikominderung. Leider ist diese statistisch unseriöse Methode inzwischen Usus geworden in den Lipidstudien.“ (Bayer)
Hohe Fallzahlen
Im Gegensatz zu z.B. sozialwissenschaftlicher Statistik, die mit 50 bis vll. 200 Fällen auskommt, arbeiten Studien über Statine mit 4.000 oder gar 20.000 Fällen und mehr. Sind Statin-Studien besonders gründlich? Nein. Sozialwissenschaftliche Statistik forscht über starke Zusammenhänge; Statine-Statistik analysiert sehr schwache. Bei niedrigeren Fallzahlen würden die Ergebnisse keine Unterschiede mehr aufweisen. Studien zu z.B. Bluthochdruck kommen oft mit 10, 20 oder 40 Patienten aus.
Noch höhere Fallzahlen, die sogar sechsstellig sein können, erreichen Statin-Statistiken in Meta-Studien, in denen ähnliche Zusammenhänge mehrerer Studien zusammengefasst werden. In den Ergebnisse summieren sich die Fehler der zugrunde gelegten Studien.
Fehlerquelle Untersuchungsdesign
Die Qualität von Studien, insbesondere medizinischer, hängt wesentlich vom Untersuchungsdesign ab.
„Eine Zufallsstichprobe ist notwendig, wenn die Stichprobe repräsentativ sein soll, d. h. wenn von ihr nach dem Induktionsprinzip auf die Grundgesamtheit geschlossen werden soll … . Mit Zufallsstichproben wird in Anwendungen der Statistik häufig gearbeitet (etwa in der naturwissenschaftlichen, medizinischen und psychologischen Forschung, bei Qualitätskontrollen oder in der Marktforschung), da es oft nicht möglich ist, die Grundgesamtheit … zu untersuchen.“ (Wikipedia)
Fallen aus einer Stichprobe viele Personen heraus – die eine Gruppe mit besonderen Eigenheiten sein könnte – muss diese Gruppe stichprobenartig untersucht werden. Das wird in keiner der Studien gemacht. In medizinischen Studien werden regelmäßig Risikogruppen ausgeschlossen, z.B. besondere Erkrankungen wie Diabetes. Das bedeutet eine Einschränkung der Übertragbarkeit der Ergebnisse. Darüber hinaus werden oft weitere Vorauswahlen getroffen, was eine weitere Einschränkung der Übertragbarkeit bedeutet.
Gültige Studien müssen randomisiert und doppelblind sein. Randomisiert bedeutet, dass die Zuordnung zu einer Behandlungsgruppe für das Medikament oder für das Placebo nach dem Zufallsprinzip erfolgt. Doppelt blind bedeutet, dass weder Arzt, noch Patient wissen, wer Medikament oder Placebo erhält. Für die Scandinavian Simvastatin Survival-Studie mussten die Autoren einräumen, dass sie entblindet war. Bei Patienten mit zu geringem Rückgang des Cholesterinwertes wurde nachträglich die Dosis erhöht.
„Die 4S-Studie zeigt einige Schönheitsfehler. … Die Placebo-Kontrollgruppe zeichnete sich außerdem durch einen hohen Raucheranteil aus und wurde nicht mit den üblichen Zucker-Placebos, sondern dem Ablagerungen fördernden Methyl-Zellstoff versorgt. Dass nur 18 Prozent der Patienten Frauen waren, verzerrte die Brauchbarkeit der Ergebnisse zusätzlich.“ (Wiwane)
Unabhängigkeit wissenschaftlicher Forschung
„Diese [S4-Studie] Studie wurde von der amerikanischen Firma Merk Sharp & Dohme initiiert, organisiert, bezahlt und in eigenen Labors überwacht.“ (Hartenbach, 2015:75)
Forschende wollen forschen, weil sie Forschende sind. Dafür braucht es eine Stelle für sich selbst, möglichst Mitarbeiter:innen, Räume, Material, Apparaturen usw. Forschungsmittel sind rar und begehrt, es herrscht große Konkurrenz. Durch ihre Forschung entdecken die Forschenden vielleicht sehr Interessantes, aber ist es faktisch ausgeschlossen, dass Forschende zu seinem/ihrem Arbeit- oder Auftraggeber z.B. mitteilt: ‚Sorry, das neue Medikament wirkt nicht.‘ Forschende müssen in den Ergebnissen etwas finden, sie so interpretieren, dass die Forschung ein positives Ergebnis hat. Und weil sie in aller Regel hochqualifiziert sind, findet sie auch eine Lösung für ihr Problem, wenn z.B. das Medikament fast wirkungslos ist. Eine dieser ‚Lösungen‘ ist die benannte ‚relative Risikoreduktion‘. Das System Wissenschaft ist in weiten Teilen durch Konkurrenz selbst korrumpierend. Forschende können aber auch durch Geld, Karriere, kostenlosen Teilnahmen an Kongressen, Publikationsmöglichkeiten usw. von indirekten Schmiergeldern profitieren. Davon gibt es leider nur wenige Ausnahmen. Eine löbliche Ausnahme ist die Cochrane-Vereinigung.
„Cochrane [ˈkɒkɹən], auch unter dem Namen Cochrane Collaboration bekannt, ist ein globales, unabhängiges Netzwerk (Geschäftsform: Charity nach britischem Recht) aus Wissenschaftlern, Ärzten, Angehörigen der Gesundheitsfachberufe, Patienten und weiteren an Gesundheitsfragen interessierten Personen. Cochrane setzt sich für dafür ein, dass Entscheidungen zu Gesundheitsfragen weltweit auf Basis hochwertiger, relevanter und aktueller wissenschaftlichen Evidenz getroffen werden und fördert die evidenzbasierte Entscheidungsfindung in Gesundheitsfragen durch die Erstellung und Verbreitung hochwertiger systematischer Übersichtsarbeiten und Metaanalysen sowie anderer Formate aufbereiteter Evidenz.
Cochrane wurde 1993 von Iain Chalmers in Oxford gegründet. Namensgeber ist der britische Arzt und Epidemiologe Archie Cochrane. Die Organisation hat ihren Sitz in London. Zur Arbeit von Cochrane tragen weltweit über 79.000 Mitglieder und Unterstützer aus über 130 Ländern bei (Stand Oktober 2019). Cochrane finanziert sich durch Einnahmen aus der Cochrane Library und anderen Cochrane-Produkten sowie durch Unterstützung von nationalen Regierungen, internationalen Regierungs- und Nichtregierungs-Organisationen, Universitäten, Kliniken, privater Förderung und persönlichen Spenden. Zur Gewährleistung der wissenschaftlichen Unabhängigkeit hat Cochrane strenge Prinzipien und Regeln für die kommerzielle (finanzielle) Förderung und den Umgang mit Interessenskonflikten. Zu diesen gehört unter anderem, dass Cochrane keine kommerzielle Förderung von der pharmazeutischen oder medizinischen Industrie oder von anderen mit den Interessen von Cochrane in Konflikt stehenden Quellen akzeptiert.“ (Wikipedia)